Hvorfor trenger kjemiske reaksjoner energi for å starte?
Det finnes en mystisk verden av kjemiske reaksjoner som utfolder seg rundt oss hver dag. Fra den bittesmå innvirkningen av en gnist til den stavrende effekten av et kjemisk stoff – energi er det hemmelige baktrekket som driver disse reaksjonene til live. Men hvorfor trenger kjemiske reaksjoner energi for å starte? Vi vil dykke inn i denne fascinerende mysteriets rike og avdekke de underliggende kreftene som driver den kjemiske verdenen på en meningsfull og tankevekkende måte. Velkommen til en reise inn i det ukjente, hvor vi skal utforske det uutforskede, forstå det ufattbare og avdekke hvorfor kjemiske reaksjoner trenger energi for å blomstre.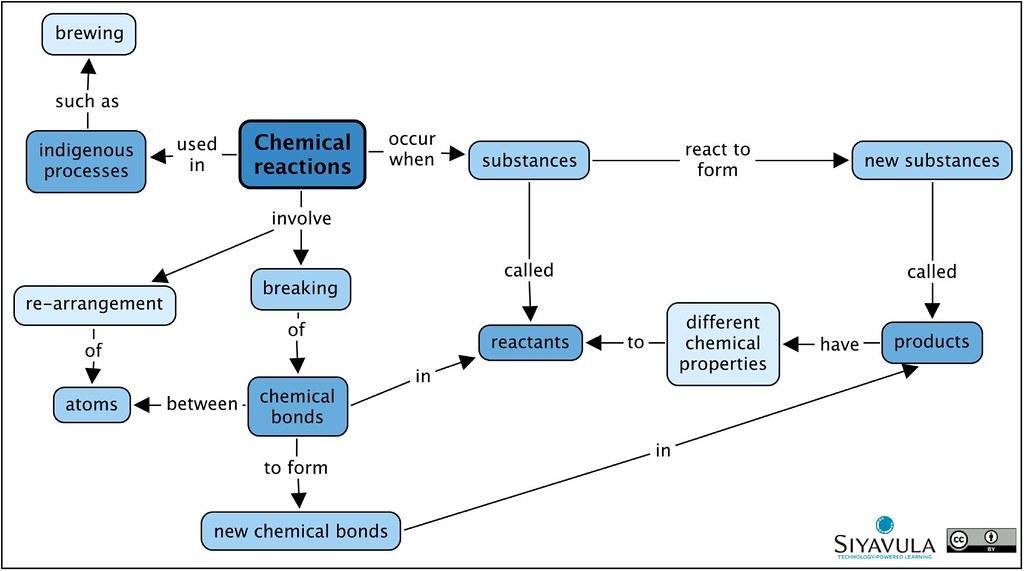
Hva er energiets rolle i kjemiske reaksjoner?

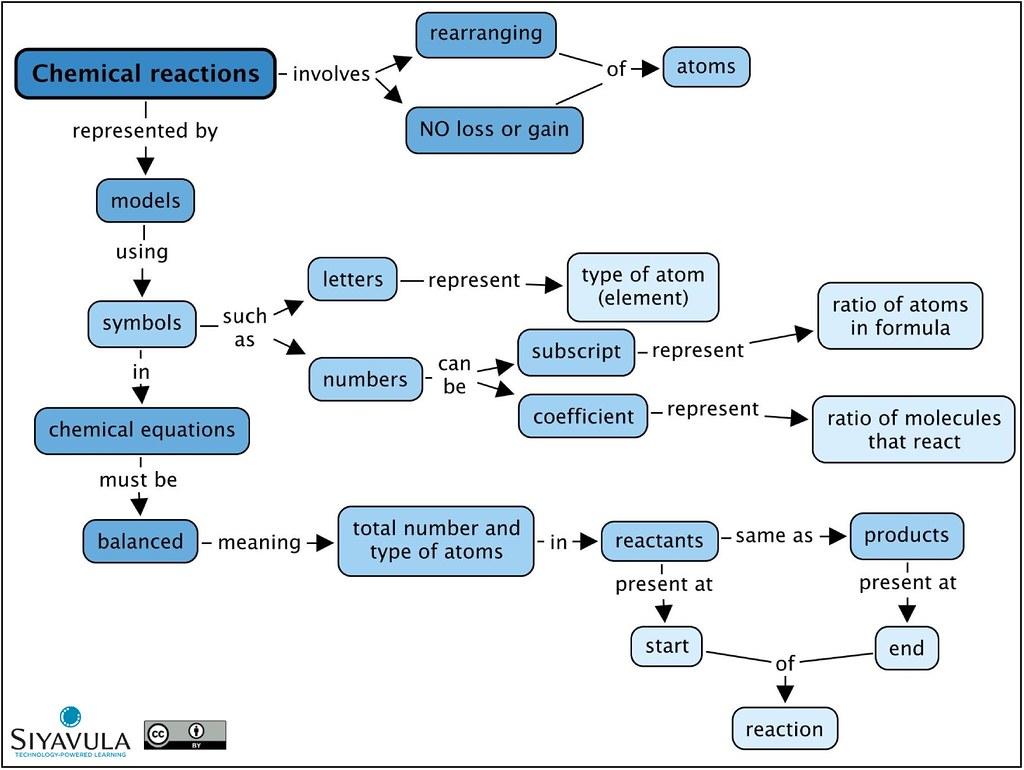
Energiets rolle i kjemiske reaksjoner er avgjørende for å forstå hvorfor disse prosessene oppstår og hvordan de påvirker omgivelsene. Kjemiske reaksjoner krever energi for å kunne starte og fortsette. Uten energi ville det ikke være mulig for atomer og molekyler å reagere og danne nye stoffer.
En av hovedårsakene til at kjemiske reaksjoner trenger energi, er for å bryte de kovalente bindingene mellom atomer i utgangspunktet. Denne energien kalles aktiveringsenergi, og den er nødvendig for å overvinne tiltrekningen mellom atomer. Når disse bindingene brytes, frigjøres energi, og nye bindinger dannes for å danne nye stoffer.
Energi kan også være involvert i form av varme (termisk energi) eller som elektromagnetisk stråling (lysenergi). Lysstråling kan for eksempel føre til at elektroner i atomer absorberer energi og hopper til høyere energinivåer, noe som igjen kan starte et kjemisk reaksjonsforløp.
Det er viktig å merke seg at energi i kjemiske reaksjoner ikke kan oppstå fra ingenting. Energien kan bare omdannes fra en form til en annen. Dette er et eksempel på hva som kalles energiprinsippet, som sier at energi verken kan skapes eller ødelegges, men bare kan overføres eller omdannes fra én form til en annen.
I tabellen nedenfor vises et eksempel på et konsentrert sammenligningsbilde av termisk og lysenergi i kjemiske reaksjoner:
| Energi | Termisk energi | Lysenergi |
|---|---|---|
| Definisjon | Energi som er forbundet med bevegelse av atomer og molekyler | Energi som overføres eller absorberes i form av elektromagnetisk stråling (lys) |
| Eksempel | Når vi oppvarmer en kopp vann og det begynner å koke | Når sollyset brytes ned i planter for å drive fotosyntesen |
| Rolle i kjemiske reaksjoner | Termisk energi kan hjelpe til med å bryte og danne bindinger i kjemiske reaksjoner | Lysenergi kan stimulere reaksjoner ved å absorbere og overføre energi til atomer og molekyler |
I sum er energiens rolle i kjemiske reaksjoner essensiell for å forstå hvordan atomer og molekyler kan forvandles til nye stoffer. Uten energi ville det ikke være mulig for kjemiske reaksjoner å starte eller fortsette, og dermed ville livet slik vi kjenner det ikke eksistert.
Potensielle kilder til aktiveringsenergi
Det er alltid fascinerende å tenke på hvorfor kjemiske reaksjoner krever energi for å starte. En av hovedgrunnene til dette fenomenet er behovet for å overvinne aktiveringsenergien. Aktiveringsenergi er den energien som trengs for å starte en kjemisk reaksjon ved å bryte bindingene mellom atomene i reaktantene.
Det finnes flere som er avgjørende for å starte kjemiske reaksjoner. Noen av de vanligste er:
-
Termisk energi: Gjennom varme kan partiklene i reaktantene få ekstra energi, som gjør at de kan utføre nødvendige bevegelser for å bryte bindingene og starte reaksjonen.
-
Lysenergi: Lys kan også brukes som en kilde til aktiveringsenergi. Når en kjemisk reaksjon eksponeres for lys av en bestemt bølgelengde, kan det absorberes av molekylene og gi den ekstra energien som trengs for å starte reaksjonen.
-
Katalysatorer: Katalysatorer er stoffer som senker aktiveringsenergien som kreves for en reaksjon ved å gi et alternativt reaksjonsvei. Dette betyr at mindre energi er nødvendig for å starte reaksjonen.
Det er viktig å huske at energi ikke blir skapt eller ødelagt under en kjemisk reaksjon. Energi blir bare omdannet fra en form til en annen. Gjennom å forstå de potensielle kildene til aktiveringsenergi, kan vi bedre forstå hvorfor reaksjoner trenger energi for å starte, og hvordan vi kan manipulere disse kildene for å kontrollere reaksjonshastigheten.
Metoder for å øke reaksjonshastigheten i kjemiske prosesser
Kjemiske reaksjoner er grunnleggende for livet slik vi kjenner det. Fra fotosyntese til fordøyelsen i kroppen vår, er reaksjonshastigheten avgjørende for hvor effektivt og raskt kjemiske prosesser oppstår. Men hvorfor trenger disse reaksjonene energi for å starte?
Å øke reaksjonshastigheten i kjemiske prosesser kan være en kompleks oppgave, men det er flere metoder som kan hjelpe til med å akselerere prosessen. Her er noen av de mest effektive teknikkene å vurdere:
-
Katalysatorer: Disse stoffene kan øke reaksjonshastigheten ved å senke aktiviseringsenergien som kreves for å starte reaksjonen. De fungerer som en slags “hjelper” som gjør det lettere for reaktantene å komme sammen og danne produktene.
-
Økning av temperaturen: Ved å øke temperaturen i systemet, øker energinivåene til reaktantene. Dette gir dem mer kinetisk energi og øker sannsynligheten for at de kolliderer og reagerer med hverandre. Imidlertid kan høye temperaturer også ha uønskede bivirkninger, som for eksempel nedbrytning av reaktantene eller dannelse av uønskede biprodukter.
-
Økning av konsentrasjonen: Når konsentrasjonen av reaktantene øker, øker også sannsynligheten for at de kolliderer og reagerer. Dette kan oppnås ved å legge til mer av reaktantene eller fjerne produktene kontinuerlig.
-
Overflateareal: Å øke overflatearealet av reaktantene gjør det mulig for flere partikler å være i kontakt med hverandre samtidig. Dette øker sannsynligheten for kollisjon og reaksjon.
-
Bruk av trykk: I noen reaksjoner kan økt trykk resultere i økt reaksjonshastighet. Dette skjer vanligvis i gasser, hvor økt trykk fører til mindre avstand mellom gasspartiklene og deres hyppigere kollisjoner.
Det er viktig å merke seg at hver metode har sine fordeler og ulemper, og den beste tilnærmingen vil variere avhengig av den spesifikke kjemiske reaksjonen som utføres. En kombinasjon av disse metodene kan også være nødvendig for å oppnå ønsket reaksjonshastighet. Ved å forstå og anvende disse metodene kan vi optimalisere kjemiske prosesser for å oppnå bedre ytelse og effektivitet.
I naturen vår omgir vi oss daglig med utallige kjemiske reaksjoner som skjer rundt oss. Fra de enkleste prosessene som å brenne et lys til de komplekse kjemiske reaksjonene som oppstår i kroppen vår. Men hva skjer egentlig når disse reaksjonene skjer? Hvorfor trenger de energi for å settes i gang?
Som vi har oppdaget gjennom forskning og eksperimenter, er energi en essensiell faktor for enhver kjemisk reaksjon. Uten energien ville disse prosessene aldri komme i gang og verden slik vi kjenner den ville bli fundamentalt forandret.
Men hva er det som driver disse kjemiske reaksjonene til å søke etter og absorbere energi? Svaret ligger i den intrikate og komplekse dansen mellom partiklene som utgjør kjemikalier. På mikroskopisk nivå er atomene og molekylene i konstant bevegelse. De vibrerer, roterer og kolliderer med hverandre.
Det er i disse energidrevne kollisjonene at reaksjonene finner sted. Når partiklene kolliderer med tilstrekkelig energi, kan bindingene som holder dem sammen brytes, og nye bindinger kan dannes. Denne energien er nødvendig for å overkomme de gjensidige tiltrekningene og frastøtningene mellom partiklene.
Dette bringer oss til det grunnleggende prinsippet om aktivert kompleks, et midlertidig og høyt energistadium som partiklene må passere gjennom før de kan danne nye forbindelser. Denne energien som kreves for å nå det aktiverende komplekset er den såkalte aktiveringsenergien.
På overflaten kan det virke motstridende at reaksjonene trenger tilført energi når vi forbinder spontane reaksjoner med frigjøring av energi. Men det er her den sanne skjønnheten i kjemi ligger – energi er nøkkelen til å kunne kontrollere og styre disse komplekse prosessene.
Ved å forstå hvordan og hvorfor kjemiske reaksjoner trenger energi for å starte, får vi et innblikk i naturens mangfold og kompleksitet. Gjennom denne kunnskapen kan vi designe og skape nye materialer, medisiner og teknologier som kan forbedre livene våre.
Så neste gang du ser en flamme danse eller tar et skritt for å utføre en oppgave, ikke glem at energi er den drivende kraften bak alt – inkludert de kjemiske reaksjonene vi forelsker oss i å utforske og forstå.

